近日,转化医学顶级期刊Science Translational Medicine在线发表了题为“Topical JAK inhibition ameliorates EGFR inhibitor–induced rash in rodents and humans”的研究论文。在该项研究中,研究团队发现先于皮肤屏障损伤之前发生的炎症反应是导致皮疹发生的早期病理变化,且局部涂抹JAK抑制剂在大鼠皮疹模型,表皮EGFR敲除小鼠模型及一项初期的临床试验中均表现出很好的缓解皮疹的效果。

英国威廉希尔公司官网博士后尤青,博士研究生陈乐颖为该论文的共同第一作者,英国威廉希尔公司官网张诗宜副教授、罗洁副教授及上海东方医院皮肤科徐楠教授为共同通讯作者。
表皮生长因子受体抑制剂(Epidermal growth factor receptor inhibitors,EGFRi)类药物现已广泛用于治疗许多癌症,但其使用会导致高比例的皮肤不良反应,主要表现为痤疮样皮疹。EGFRi治疗导致的皮疹发病率高达92.4%。皮疹的发生不仅严重影响患者的生活质量还可能迫使EGFRi治疗剂量的下调甚至中断,最终降低抗肿瘤治疗的临床效果。目前,针对EGFRi导致皮疹的机制研究主要集中在皮疹发生的中后期,皮疹发生的早期病理变化尚不明确。
由于缺乏详细的分子病理学机制研究,针对EGFRi导致的皮疹目前并无理想治疗方案。临床使用的药物主要包括广谱抗生素和皮质固醇类,结合物理性防晒、防止机械压力损伤以及保持皮肤湿润等。这些方法并非针对性治疗,仅能部分改善皮疹症状,并不能完全缓解由EGFRi导致的皮疹,因此,探索EGFRi导致的皮疹的病理机制并开发针对性治疗药物迫在眉睫。
大量的临床和实验数据表明,EGFRi诱导的皮疹是一种炎症性皮肤疾病。但炎症是皮肤病变的触发因素还是皮肤病变的继发反应尚不清楚。课题组前期一直致力于研究表皮生长因子受体抑制剂类药物导致的副作用并成功构建了以afatinib(阿法替尼)为代表的EGFRi诱导的大鼠皮疹模型。研究团队利用该大鼠模型,在皮疹发生的临界点对大鼠皮肤组织进行了高通量转录组分析,发现大量炎症相关通路的显著富集,其中包括JAK-STAT信号通路(图1)。
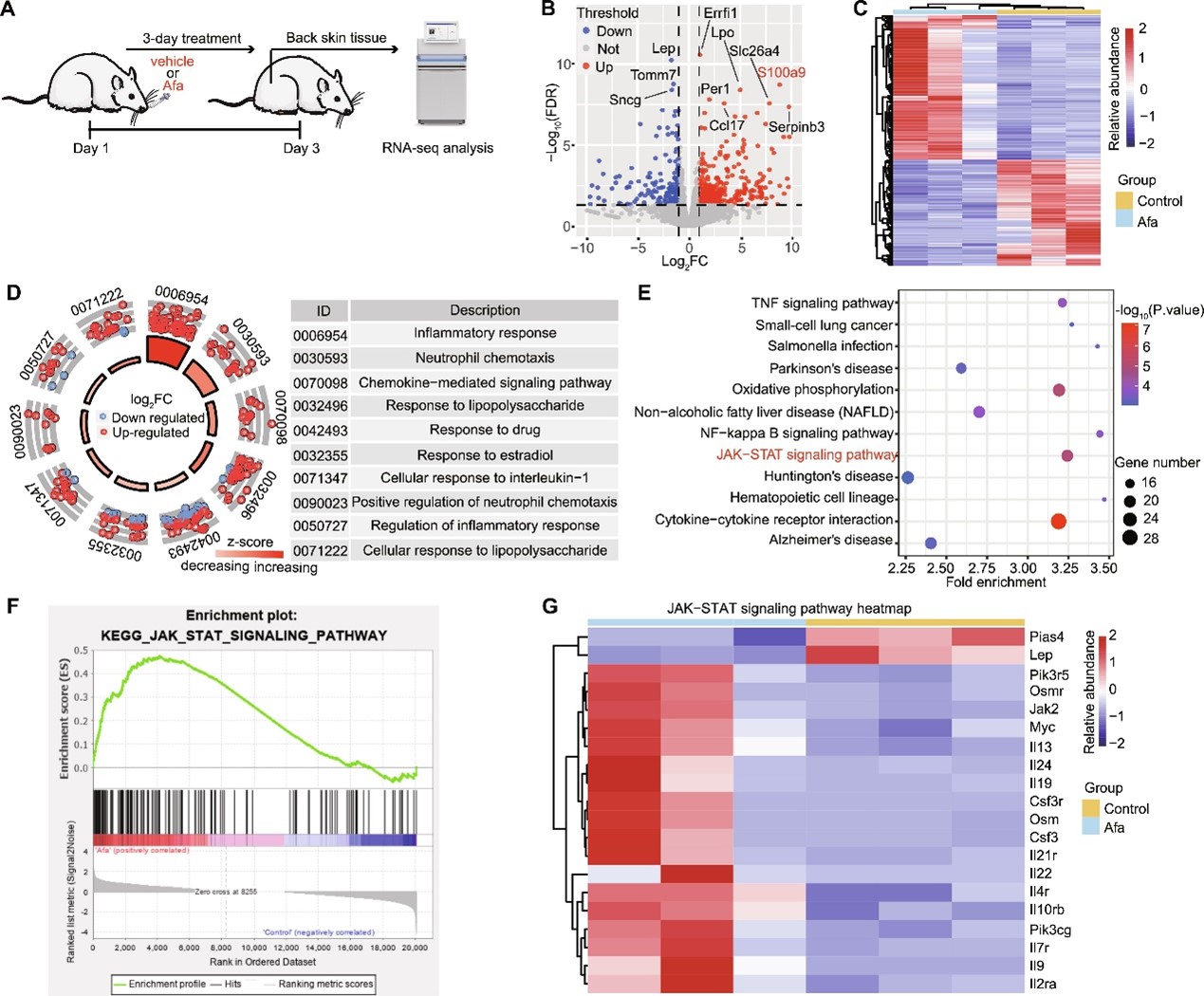
图1. 炎症是afatinib处理大鼠皮肤组织中的早期病理变化
进一步的分析显示大鼠皮肤的屏障功能在该时间点仍保持完好,因此,先于皮肤屏障损伤发生的炎症反应是皮疹的早期病理变化。进一步的机制分析表明,警示素S100A9分子的早期高表达可能是激活角质形成细胞的诱因,刺激其表达特定的细胞因子、趋化因子及表面粘附分子,进而通过JAK-STAT信号通路招募活化单核细胞,最终招募更多的免疫细胞扩大炎症级联反应(图2)。
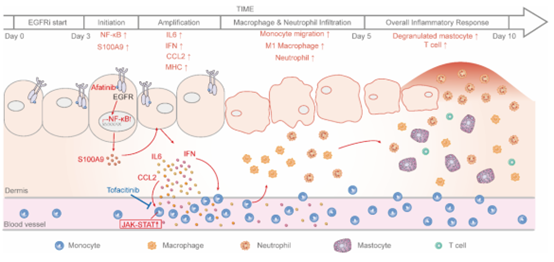
图2. EGFRi导致皮疹的机制
进一步,研究团队发现通过JAK抑制剂阻断JAK-STAT信号通路能够抑制免疫细胞的招募进而缓解皮疹。在afatinib诱导的大鼠模型中,局部涂抹JAK抑制剂tofacitinib(托法替尼)可显著改善皮疹症状,减少免疫细胞浸润,并保持皮肤屏障完整性。研究还表明,局部施用tofacitinib并不会干扰afatinib在荷瘤小鼠中的抗肿瘤功效。
该研究的发现还在表皮EGFR缺失的小鼠模型中得到了进一步验证。局部应用另一种JAK抑制剂delgocitinib(迪高替尼)改善了这些小鼠的皮肤异常,证明了JAK抑制剂在EGFR缺失条件下更广泛的适用性。
研究人员还将他们的临床前研究结果转化为临床,在癌症患者中进行了一项初期的临床研究。11例皮疹患者接受了delgocitinib软膏治疗,其中10例患者的皮疹严重程度改善了至少1级。此外,外用delgocitinib软膏显著改善了大多数患者的生活质量,且该治疗耐受性良好,无不良反应报告。
综上所述,该研究提供了对于EGFRi导致皮疹的早期病理变化的新理解并提出了针对EGFR抑制或缺失所导致皮肤问题的一种转化策略。
课题组长期致力于研究抗肿瘤药物的副作用。除了针对EGFR抑制剂引起的皮疹进行了深入研究外,还系统性地探讨了其他常用临床化疗药物和靶向药物导致的多种皮肤副作用,如手足皮肤反应和手足综合征。此外,我们还研究了放化疗引起的腹泻、化疗导致的肝毒性、神经毒性以及骨髓抑制作用。我们的研究成果已发表多篇学术论文,并正积极推动这些研究的临床转化应用。
